蝴蝶兰‘红天鹅’组织培养及快繁技术
蝴蝶兰‘红天鹅’组织培养及快繁技术
蝴蝶兰(Phalaenopsis spp.)属兰科蝴蝶兰属,具有“兰中皇后”的美称,其观赏价值与经济价值较高,近年来颇受消费者的喜爱 。目前,蝴蝶兰新品种大部分依旧是引进自台湾,因此,推广自主知识产权的新品种对提高我国蝴蝶兰产业竞争力具有重大意义。
蝴蝶兰‘红天鹅’是以‘宝岛玫瑰’和‘超群火鸟’为亲本,通过杂交育种方法选育出的新品系,于2015 年通过了福建省林木品种审认定。该品种具有花瓣质地厚,花色深红,开花早,花期长,耐低温,适合中国大陆年销市场等优点,具有很好的应用前景。由于蝴蝶兰的后代易分离、生长不同步,并且随种植年限的增加,品种容易产生退化,因而组织培养技术的研究显得尤为重要。目前,有关蝴蝶兰的组织培养的文献较多 [2-6] ,组培技术比较成熟,但不同蝴蝶兰品种的组培条件差别较大,该文以自主研发的蝴蝶兰新品种‘红天鹅’为诱导材料,开展组织培养技术研究,优化其外植体诱导、继代增殖、生根诱导、移栽驯化等条件,以期建立高效的组培快繁技术体系,为蝴蝶兰新品种‘红天鹅’的推广应用奠定基础。
1 材料与方法
1.1 材料
蝴蝶兰‘红天鹅’为福建省林业科技试验中心自主研发的新品种,栽培于试验中心的温室大棚中。
1.2 方法
1.2.1 外植体诱导。将蝴蝶兰‘红天鹅’的花梗用剪刀剪掉花朵,用洗衣粉溶液浸泡 20 min,在流水下冲洗 20 min,之后放于超净工作台上待消毒。消毒步骤:先用 75%酒精轻轻摇晃处理 30~45 s,再用 HgCl 2 分别消毒 10、15、20、25 min,最后用无菌水清洗 4~5遍,接种到诱导培养基中。诱导培养基为 1/2MS+6-BA6.0 mg/L+NAA 0.2 mg/L+ 蔗糖 30 g/L+ 琼脂 7.5 g/L。不同 HgCl 2 消毒处理接种 30 瓶,每个培养瓶接入 1 个腋芽,试验重复 3 次,放置在培养室中培养20 d 后,统计污染率和萌发率。
污染率(%)= 污染瓶数 / 接种总瓶数×100,
萌芽率(%)= 萌发瓶数 / 未污染瓶数×100。
1.2.2 增殖培养。在以 MS+AD 5.0 mg/L+ 香蕉 50 g/L+土豆 50 g/L+ 蔗糖 30 g/L+ 琼脂 7.5 g/L 为基础培养基上,添加不同浓度 6-BA 和 NAA,设置 6-BA 浓度分别为 5.0、6.0、7.0、8.0 mg/L,NAA 为 0、0.1、0.2、0.3 mg/L(表 2),分析不同浓度 6-BA 和 NAA 对不定芽增殖系数及不定芽生长情况的影响。培养基代号分别为P1~P9,每种培养基接种 30 瓶,每个培养接种 5 丛不定芽,试验重复 3 次,放置于培养室中培养 45 d 后,观察不定芽生长情况并统计增殖系数。
增殖系数 = 不定芽数 / 接种的不定芽数。
1.2.3 生根诱导。以 1 /2MS+ 香蕉 50 g/L+ 土豆 50g/L+C 1.0g/L+ 蔗糖 15 g/L+ 卡拉胶 7.0 g/L 为基础培养基,分析比较不同浓度 NAA 对不定根诱导的影响,NAA 浓度分别设置为 0、0.4、0.6、0.8 mg/L。不同培养基代号分别为 R1~R4。每个处理号接种 30 瓶,每个培养瓶接入 5 个芽,试验重复 3 次,放置于培养室中培养 45 d 后,观察生根情况并统计生根率。
生根率(%)= 生根苗数 / 接种芽数×100。
1.2.4 炼苗与移栽。蝴蝶兰组培生根苗长到 3~5 cm,且有 3~4 片叶及 3 条以上粗壮的不定根时,可进行炼苗与移栽 。将培养瓶的盖子打开,使组培苗逐渐适应外界的环境,从而增强其对外部环境的抗性。移栽时,用水先清洗掉粘在不定根的培养基,之后用高锰酸钾溶液(0.1%)浸泡 10 min,最后,将其晾干并定植。移栽的基质选择 5 种不同基质,代号分别为S1~S5,基质选择松散,且通气和透水性较好的基质(表 5),每种不同基质移栽 30 株,重复 3 次,温室大棚栽培 30 d 后观察移栽苗生长情况,统计移栽成活率。
1.3 培养条件
以上用到的培养基 pH 均为 5.80;组培培养温度为 23±2℃,光照强度为 3 000 Lx,光照周期为 10h/d。 移 栽 时 白 天 温 度 控 制 在 25~28℃ , 夜 间20~22℃,相对湿度为 70%~80%。
2 结果与分析
2.1 不同 HgCl 2 消毒时长对花梗诱导的影响
蝴蝶兰‘红天鹅’的花梗经诱导培养 20 d 后,开始萌发出不定芽(图 1)。由表 1 可见,随着 HgCl 2 消毒时间的延长,污染率由 75.5%下降至 27.2%,当消毒处理时间由 20 min 延长至 25 min 时,污染率有所上升,但在 0.01 水平上差异不显著,而萌芽率则显著降低。表 1 中也可看出,消毒时间控制在 20 min 内,蝴蝶兰花梗的萌芽率高达 92.2%,但当消毒时间延长,萌芽率则开始下降。综合考虑消毒时长对污染率和萌芽率的影响,该试验选择 HgCl 2 消毒时长为 20 min。
表 1 HgCl 2 消毒时长对蝴蝶兰花梗诱导的影响
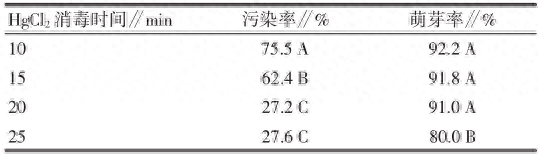
注:同列数值后不同大写字母表示方差分析差异显著(P<0.01)。

图 1 蝴蝶兰花梗的诱导
2.2 激素浓度对不定芽继代增殖的影响
将蝴蝶兰的花梗诱导出的不定芽接种到继代培养基中,观察不定芽生长情况并分析增殖系数。由表2 可见,当培养基中添加一定浓度的 6-BA 和 NAA 时,有利于蝴蝶兰‘红天鹅’的继代苗增殖培养。当 6-BA浓度增加时,增殖系数也随着提高。当 6-BA 为6.0 mg/L 时,增殖系数为 3.80,芽粗壮(图 2);当 6-BA为 7.0 mg/L 时,增殖系数达到 4.20,但是苗变得细弱;随着 6-BA 浓度增加到 8.0 mg/L 时,增殖系数降低,继代苗成团状,苗单株不明显,不利于后续的生根培养,这是因为高浓度的 6-BA 反而不利于继代苗的增殖,因此该试验选择 6-BA 浓度为 6.0 mg/L。由表 2 所示,添加低浓度的 NAA 对蝴蝶兰的继代增殖有促进作用,不添加 NAA 时,增殖系数较低,但添加0.1~0.3 mg/L 差异不显著,因此基于成本方面的考虑,该试验选择 NAA 的浓度为 0.1 mg/L。

图 2 蝴蝶兰继代培养
2.3 不同生长素浓度对‘红天鹅’生根诱导的影响蝴蝶兰‘红天鹅’不定芽长到 3~5 cm 时,并且有3 片叶子以上,将其切下并接入生根诱导培养基中,15 d 后开始长出白色根原基,45 d 后不定根长成(图 3)。由表 3 可知,在添加 NAA 的生根诱导的培养基中,蝴蝶兰‘红天鹅’生根率均能达到 100%。在R1~R4 培养基中,NAA 浓度的变化对蝴蝶兰生根时间的影响效果显著。当 NAA 浓度为 0.4 mg/L 时,生根时间短至 15 d,根数 3~5 条,适合移栽。NAA 浓度增加到 0.6 mg/L,生根时间反而开始延长,因而选择蝴蝶兰的生根诱导培养基为 1 /2MS +NAA0.4 mg/L +香蕉 50 g/L+ 土豆 50 g/L+C1.0 g/L+ 蔗糖 30 mg/L+琼脂 7.5 g/L。

图 3 蝴蝶兰生根诱导
2.4 不同移栽基质对‘红天鹅’生根苗移栽成活率的影响
由表 4 所示,经方差分析表明,蝴蝶兰组培苗移栽在不同的基质中,其成活率之间的差异在 0.05 水平上显著。通过对不同移栽基质的成活率的比较,以水苔为基质,成活率最高,达 90.1%,苗粗壮,根系良好,叶片展开(图 4);其次是以蛭石为移栽基质,成活率达 80.9%;以草炭:珍珠岩为 1∶1 作为移栽基质时的成活率最低。这可能是由于蝴蝶兰的根是肉质的气生根,其适于在疏松、透气且具有保肥保水性能的基质中生长。在表 4 中的基质中,水苔尤其具有柔软并且保水和肥力强的特点,适合作为蝴蝶兰组培苗的移栽的基质。

图 4 蝴蝶兰移栽
表 2 激素浓度对不定芽继代增殖的影响
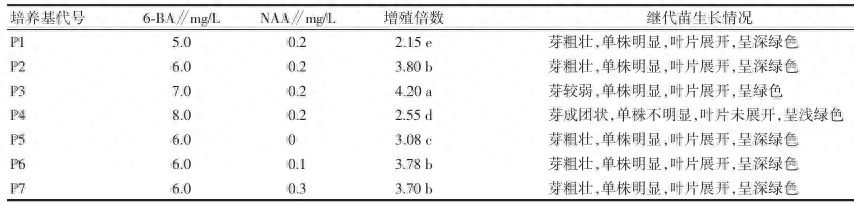
注:表中不同小写字母表示方差分析差异显著(P<0.05)。
表 3 不同生长素浓度对‘红天鹅’生根诱导的影响

注:表中不同小写字母表示方差分析差异显著(P<0.05)。
表 4 不同移栽基质对‘红天鹅’生根苗移栽成活率的影响

注:表中不同小写字母表示方差分析差异显著(P<0.05)。
3 讨论
‘红天鹅’是福建省林业科技试验中心和漳州森晖兰花有限公司共同自主研发的新品种,于 2015 年通过了福建省林木品种审认定,这个品种具有花瓣质地厚、花色深红、开花早、花期长、耐低温、适合中国大陆年销市场等优点,具有很好的应用前景。目前还未在市场上大量推广,因此其组织培养技术的研究对蝴蝶兰新品种‘红天鹅’甚至其他蝴蝶兰品种的组织培养及快繁有较好的借鉴作用。
该试验以‘红天鹅’的花梗作为外植体,用 0.1%的 HgCl 2 进行消毒,摸索出适合外植体消毒的方案,使污染率降低到了 27.2%,大大提高了蝴蝶兰无菌外植体系建立的成功率,这与其他文献报道的指标相比有一定的提高 [2-6] 。通过培养基的优化试验,不定芽增殖系数达到 3.80,生根率达 100%,满足了蝴蝶兰‘红天鹅’产业化生产的要求,为蝴蝶兰新品种优质种苗的推广应用提供参考。
热门文章
-
手机为什么会自动跳屏怎么解决(手机闪屏乱跳怎么解决?)
咱们得知道,华为手机闪屏乱跳,这背后可能藏着软件的小脾气,也可能是硬件在悄悄抗议。咱们先从软件这块儿入手,试试下面这几招“温柔疗法”。第一招,重启手机。你想啊,手机就像咱们人一样,忙活了这么久,总得让它喘口气吧。长按那个电源键,选重启,说不定手机一开心,闪屏乱跳的问题就自个儿消失了。第二招,给屏幕做 -
幸福树为什么掉叶子(幸福树掉叶子,主要有3个原因)
幸福树是一种非常受欢迎的绿植,它树形高大,绿叶婆娑,名字好听,摆在居室中不但可以美化环境,还有非常吉祥的寓意。不过很多朋友养的幸福树,总是养得没多久叶子就开始干枯,甚至全部落光一命呜呼,这是怎么回事呢?接下来咱们一起学习。1、浇水不当幸福树的叶子比较多,又非常薄,所以需要的水分相对是比较多的,如果浇 -
信用卡未销户什么意思(银行卡长期不使用也没注销?后果很严重!)
银行卡长期不使用也没注销会产生什么后果?一张银行卡从开户起,就会产生如下固定费用:工本费5元(有的芯片卡10元),年费10元,小额账户管理费每季度至少3元,合计至少27元。除去工本费,从第二年开始每年至少22元。如果开通短信服务,每月至少2元,全年24元,三项费用合计至少46元。即使你长期不用卡,且 -
蟹爪兰功效作用(5种“催眠花”,会在夜间造氧气)
很多人喜欢在家里养一些花花草草,来净化空气,提升家里生机勃勃的气息,家里养花也是非常有讲究的,比如有些花是带有毒性的,千万不能在家里养,但是有些花卉植物却有着对人身体健康有帮助的作用,家里养一盆,睡得香,身体棒,家里没钱也要养,那哪些植物这么有效果呢?养一盆“安眠花”放在卧室里,这些植物具有释放氧气 -
蟹爪兰植物养护技巧(蟹爪兰如何养护)
1、光照和温度:蟹爪兰属于短日照植物,要提供散射光,避免太强的光。冬天和春天,一般光线不会太强,可放置光线充足的位置。蟹爪兰在5℃~30℃,都可以正常生长。但是冬天最好放在室内养护。2、土壤:蟹爪兰用疏松、肥沃、排水性好、微酸性土壤种植,种植的时候,土壤里掺入适量底肥。3、浇水:夏天是蟹爪兰的休眠期 -
蟹爪兰的风水作用及其摆放方法(蟹爪兰摆放有讲究,3个位置养护花量大打折扣)
蟹爪兰是秋冬季节花友们都很喜欢的一种花卉,作为一种花叶一体的花卉,蟹爪兰是比较特别的,长势旺盛,观赏价值极高,很多花友都喜欢在家里养几盆,而且还是一种年宵花,开花之后很喜庆。不过有花友说自己养护的蟹爪兰总是长不好,而且叶片发软,看上去一点也不好看。其实养护蟹爪兰,除了正确的养护之外,比如合理浇水,不 -
蟹爪兰的植物简介(花百科:蟹爪兰)
蟹爪兰仙人掌科·蟹爪属蟹爪兰1.形态特征附生肉质植物,常呈灌木状,无叶。茎无刺,多分枝,常悬垂,老茎木质化,稍圆柱形,幼茎及分枝均扁平;每一节间矩圆形至倒卵形,长3-6厘米,宽1.5-2.5厘米,鲜绿色,有时稍带紫色,顶端截形,两侧各有2-4粗锯齿,两面中央均有一肥厚中肋;窝孔内有时具少许短刺毛。花 -
蟹爪兰适应温度是多少(蟹爪兰做好花期调控,花开一整年)
蟹爪兰又名为圣诞仙人掌、蟹爪莲或者仙指花,是仙人掌科蟹爪兰属的花卉植物。蟹爪兰开花正逢圣诞节、元旦节,花朵婀娜娇艳,美丽动人。如果采用垂挂吊盆栽培,蟹爪兰反卷的花朵更是可爱。蟹爪兰非常适合装饰在窗台、门厅,美胜锦帘,深受大家的喜爱。1、温度管理蟹爪兰性喜温暖环境,生长适宜温度为18-25度,严忌寒冷 -
嫁接蟹爪兰的植物有哪些(3种仙人掌科植物,哪个嫁接后亲和力更好?)
现在蟹爪兰基本都已经开完花,开始进入新的生长阶段,很多花友也会利用这段时间给蟹爪兰进行嫁接,这样更容易养护,开花量更多,而且观赏效果更佳。蟹爪兰是仙人掌科植物,嫁接砧木当然也需要同是仙人掌科植物,那么在嫁接蟹爪兰时,用哪种植物做砧木更合适呢?叶仙叶仙虽然长有枝干,但它也是仙人掌科的一种植物,植株长有 -
蟹爪兰寓意及花语是什么(4种花“旺运又招财”,寓意吉祥添富贵)
1、鸿运当头鸿运当头是一种非常受欢迎的家庭花卉,也非常适合新手养殖,摆放在家里的客厅,红火喜庆,有很好的旺运招财意。鸿运当头红色的花朵花期很长,很漂亮,观赏价值非常高。疏松的土壤,可以让鸿运当头长的更好一些,同时土壤可以将泥土和细沙混合使用,这样就可以确保土壤里面富含足够的营养成分。鸿运当头喜爱潮湿
